2-2-2
以下为《2-2-2》的无排版文字预览,完整格式请下载
下载前请仔细阅读文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
第二单元 化学反应的方向和限度 化学平衡状态一、化学平衡的研究对象--(1)定义:在同一条件下,既可以向正反
应方向进行,同时又可以向逆
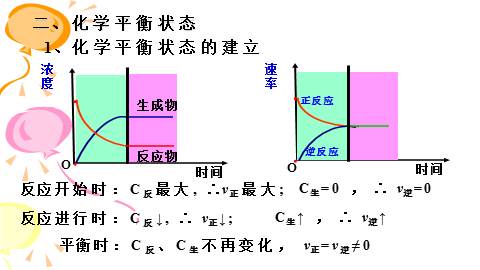
反应方向进行的反应可逆反应③可逆反应有一定的限度。 (2)大部分化学反应都是可逆反应。用“ ”(3)可逆反应的特点: ①正反应和逆反应发生的条件相同; ②反应物、生成物共同存在;(反应不彻底)1、化学平衡状态的建立二、化学平衡状态平衡时:C反、C生不再变化, v正=v逆≠0反应开始时:C反最大, ∴v正最大;反应进行时:C反↓, ∴ v正↓; C生=0 , ∴ v逆=0C生↑ , ∴ v逆↑2、化学平衡状态 可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应的速率相等,反应物和生成物的浓度不再发生变化的状态叫化学平衡状态。(1)定义(2)化学平衡的特征:逆、等、定、动、变。可逆反应速率相等浓度不再发生变化3、化学平衡状态的判断(1)v正=v逆v生成=v消耗速率比=系数比,
且一个v正,一个v逆①v生成(N2)=v消耗(N2)③单位时间内:生成1molN2同时生成2molNH3消耗1molN2同时消耗2molNH3生成1molN2同时消耗3molH2同一物质:不同物质:②3v正(N2)=v逆(H2)v正(N2)/ v逆(H2) = 1/3④断裂1mol N≡N同时生成3mol H-H断裂1mol N≡N同时断裂6mol N-H注:v(N2):v(H2):v(NH3)=1:3:2,不一定平衡。(2)反应混合物中各组分的浓度(百分含量)不变①各组分的物质的量浓度 C②各组分的物质的量(n)、n%③各组分的质量(m)、m%④各组分的体积(V)、V%注:n(N2):n(H2):n(NH3)=1:3:2,不一定平衡。C C C(3)其它关键:正逆相等,变量不变①转化率不变:(转化量/起始量)×100%④P总,V总,n总②颜色不变达到平衡⑤密度⑥平均摩尔质量③温度:任何化学反应都伴随着能量变化,体系温度不变时,达到平衡[全文已结束,注意以上仅为全文的文字预览,不包含图片和表格以及排版]
以上为《2-2-2》的无排版文字预览,完整格式请下载
下载前请仔细阅读上面文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
图片预览