勒夏特列原理——简单作图巧理解
以下为《勒夏特列原理——简单作图巧理解》的无排版文字预览,完整格式请下载
下载前请仔细阅读文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
勒夏特列原理
**_*学 李光耀
Tel:*** E-mail:***@qq.com
人教版高中化学选修4第二章第3节
——简单作图巧理解
勒夏特列原理
如果改变影响平衡的条件之一(如浓度、温度、压强),平衡将向着能够减弱这种改变的方向移动。
理解关键词:
①方向不变,程度减小
②“减弱”≠“消除”,更不是“扭转”
1、浓度对化学平衡的影响
增大反应物浓度,化学平衡向 的方向移动。
正反应
2、温度对化学平衡的影响
增大压强,化学平衡向 的方向移动。
气体减少
3、压强对化学平衡的影响
升高温度,化学平衡向 的方向移动。
吸热
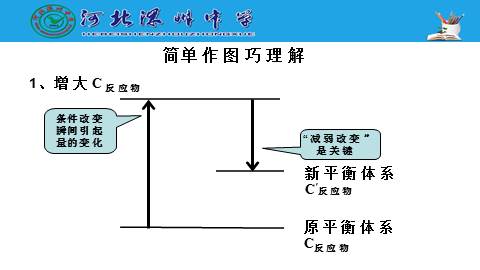
增大反应物的浓度时,平衡移动的结果是把反应物继续转化为生成物,从而“减弱”了反应物浓度的“增加”
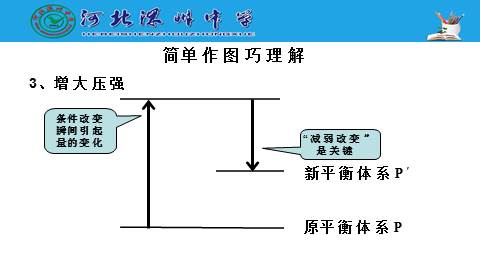
气体的减少使压强减小了,“减弱”了“压强增大”的效果。
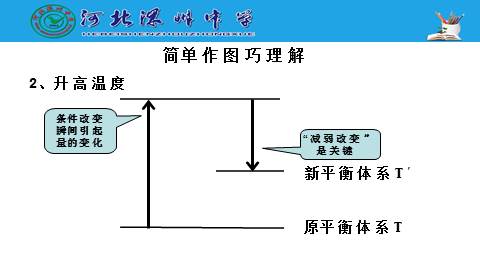
反应向吸热的方向进行,吸收了部分外界提供的能量,导致体系的温度不至于升高那么多,即“减弱”了温度的升高。
勒夏特列原理的理论依据
1、增大C反应物
简单作图巧理解
2、升高温度
简单作图巧理解
3、增大压强
简单作图巧理解
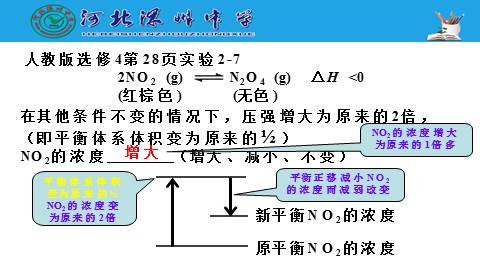
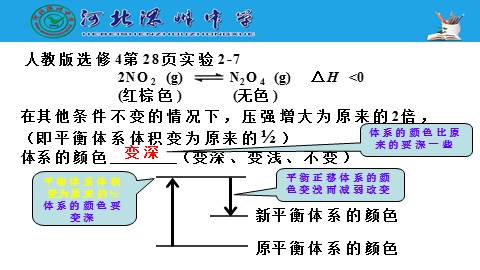
人教版选修4第28页实验2-7
在其他条件不变的情况下,压强增大为原来的2倍,
(即平衡体系体积变为原来的?)
NO2的浓度 (增大、减小、不变)
2NO2 (g) N2O4 (g) △H <0
(红棕色) (无色)
增大
平衡体系体积变为原来的?
NO2的浓度变为原来的2倍
平衡正移减小NO2的浓度而减弱改变
NO2的浓度增大为原来的1倍多
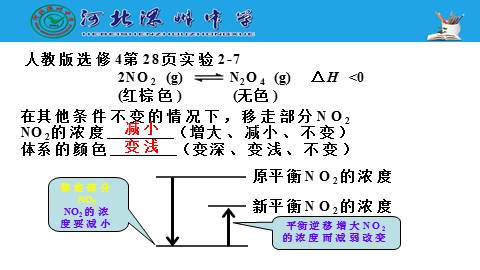
人教版选修4第28页实验2-7
在其他条件不变的情况下,压强增大为原来的2倍,(即平衡体系体积变为原来的?)
体系的颜色 (变深、变浅、不变)
人教版选修4第28页实验2-7
在其他条件不变的情况下,移走部分NO2
NO2的浓度 (增大、减小、不变)
体系的颜色 (变深、变浅、不变)
2NO2 (g) N2O4 (g) △H <0
(红棕色) (无色)
减小
移走部分NO2
NO2的浓度要减小
变浅
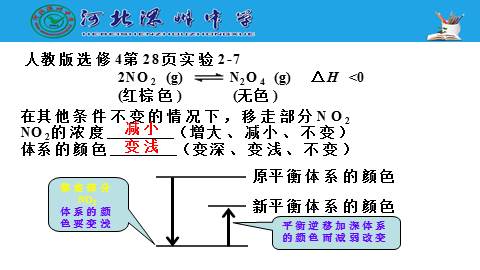
人教版选修4第28页实验2-7
在其他条件不变的情况下,移走部分NO2
NO2的浓度 (增大、减小、不变)
体系的颜色 (变深、变浅、不变)
2NO2 (g) N2O4 (g) △H <0
(红棕色) (无色)
减小
移走部分NO2
体系的颜色要变浅
变浅
小结:运用勒夏特列原理时要注意的一些问题
⑴ 此原理使用的前提是已经达到平衡的体系。
⑵ 只有改变影响平衡的条件时,才能使平衡发生移动。
⑶ 平衡移动的结果是“减弱”影响,而非“消除”影响。
⑷ 当同时改变影响平衡的几个条件时,勒夏特列原理对每个条件来说仍然适用,但平衡实际移动的方向是多个条件综合影响的结果,并决定于主要的影响因素。
演示完毕
**_*学 李光耀
Tel:***
E-mail:***@qq.com[全文已结束,注意以上仅为全文的文字预览,不包含图片和表格以及排版]
以上为《勒夏特列原理——简单作图巧理解》的无排版文字预览,完整格式请下载
下载前请仔细阅读上面文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
图片预览